2017年8月16日,Vascular Dynamics醫(yī)療器械公司稱,美國食品與藥品監(jiān)督管理局(FDA)批準(zhǔn)了該公司研發(fā)的用于治療頑固性高血壓病的設(shè)備MobiusHD的臨床試驗(yàn)研究器械豁免(IDE)。
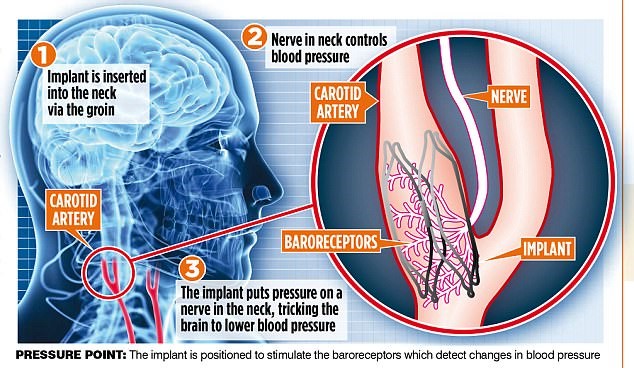
MobiusHD旨在幫助高血壓病患者通過在頸動脈壓力感受器植入電極刺激該處的動脈壓力感受器對血壓進(jìn)行調(diào)節(jié)。
以Vascular Dynamics醫(yī)療器械公司為基礎(chǔ)的加州山景城互聯(lián)網(wǎng)公司稱,包括300名高血壓病患者在內(nèi)的Calm 2研究項(xiàng)目旨在對高血壓病患者分別接受MobiusHD治療和假手術(shù)處理后的效果進(jìn)行比較。主要安全性終點(diǎn)是死亡、心肌梗死、卒中、設(shè)備栓塞、頸動脈閉塞、同側(cè)頸動脈出現(xiàn)新的狹窄需要手術(shù)或經(jīng)皮介入治療或在90天內(nèi)出現(xiàn)出血學(xué)術(shù)研究聯(lián)合會(BARC)規(guī)定的3或5例出血事件。主要有效性終點(diǎn)是在180天之內(nèi)平均24小時動態(tài)收縮壓的變化水平。
Calm 2計(jì)劃于9月開始,終結(jié)果將于2020年5月公布。Vascular Solution也參與看FDA的快速審批程序,同時也是參加該機(jī)構(gòu)前期可行性研究開發(fā)研究器械豁免(IDE)試點(diǎn)項(xiàng)目的九家公司之一。
啟動“Calm 2”試驗(yàn)對Vascular Dynamics醫(yī)療器械公司來說具有重要的里程碑意義,因?yàn)樗刮覀冇袡C(jī)會在重要的高血壓病患者群體中展示我們開發(fā)的技術(shù)所具有的潛在效益。總裁兼首席執(zhí)行官Robert Stern在事先準(zhǔn)備好的講話中表示,我們在參與EAP和IDE項(xiàng)目的同時,也有特別的機(jī)會與FDA密切合作,以確保更快速地啟動試驗(yàn),同時保持審批程序所要求的高安全性、有效性和科學(xué)有效性。
獲取新臨床研究咨詢,了解更多疾病知識,歡迎訪問:http://www.51xinkang.com





